- Por que alguns insetos conseguem andar em cima da água?
- Como se formam as bolhas de sabão?
- Por que uma lâmina de barbear, cuja densidade é maior que a da água, consegue flutuar sobre a superfície dela, se for colocada de modo horizontal?
- Por que o gelo flutua na água?
- Por que o ponto de fusão e o ponto de ebulição de determinados compostos são maiores que de outros?
Todas essas perguntas podem ser respondidas quando passamos a entender o que mantém as moléculas das substâncias unidas. Os químicos desenvolveram estudos sobre as forças de atração que se estabelecem entre as moléculas e as denominaram de forças de van der Waals, em homenagem ao cientista holandês Johannes Diederik van der Waals (1837-1923), responsável pela descoberta da fórmula matemática que permitiu o estudo desse assunto.
As três principais forças de van der Waals são: forças de dipolo induzido, forças de dipolo permanente e ligações de hidrogênio (anteriormente chamadas de pontes de hidrogênio, termo considerado incorreto hoje em dia).
A ligação de hidrogênio é a força intermolecular mais intensa dessas três e pode ser definida da seguinte maneira:

Essa união é forte porque o flúor, o oxigênio e o nitrogênio de uma molécula possuem pares de elétrons não ligantes, sendo muito eletronegativos, e o hidrogênio de outra molécula fica com carga parcial positiva, e, por isso, são atraídos, formando um dipolo. Portanto, o grau de polarização é muito acentuado, o que mantém as moléculas bem unidas.
Um exemplo mais comum dessa força intermolecular é a que ocorre entre as moléculas de água. Conforme se pode observar abaixo, moléculas de água no estado líquido são atraídas umas às outras pela “ligação” entre o hidrogênio de uma molécula com o oxigênio de outra:
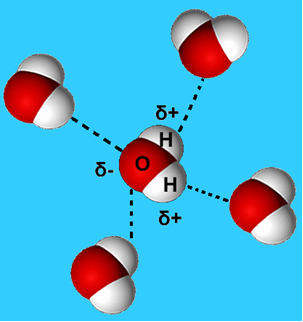
Na água líquida, essas moléculas ainda têm certa mobilidade. No estado sólido, porém, as ligações de hidrogênio entre as moléculas fazem com que elas fiquem dispostas tridimensionalmente de forma organizada, numa grade cristalina com espaços vazios, como é mostrado a seguir. Isso nos explica por que o gelo é menos denso que a água e flutua quando colocado nela.
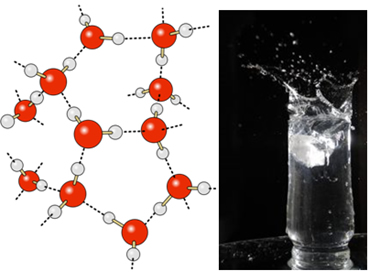
As ligações de hidrogênio na água são ainda mais fortes na sua superfície, onde não há moléculas em todas as direções, somente abaixo e dos lados. Com isso, forma-se uma tensão superficial, ou seja, uma espécie de película ou membrana elástica na superfície da água. Nesse caso, a tensão superficial é tão alta que permite que alguns insetos caminhem sobre ela.
Esse mesmo fenômeno explica por que uma lâmina de barbear, que possui densidade de 8 g/cm3, bem maior que a densidade da água (0,9 g/cm3), pode flutuar sobre ela quando colocada de modo horizontal em sua superfície.
.jpg)
Além disso, é também a tensão superficial da água que faz com que as bolhas de sabão existam. As moléculas de água que estão na superfície da bolha estabelecem ligação de hidrogênio somente com as moléculas ao seu lado. Por não existir moléculas acima e nem abaixo, a ligação se torna ainda mais forte e para diminuir essa superfície ao mínimo, a bolha assume a forma esférica, que é a que apresenta a menor relação entre área superficial e volume. A bolha explode porque as moléculas do detergente se colocam entre as moléculas de água e diminuem essa tensão superficial. As gotas de água também ficam esféricas devido a isso.

Exatamente por ser a força de atração mais intensa entre as moléculas, é que os compostos que fazem ligações de hidrogênio possuem pontos de fusão e ebulição maiores, pois será necessário inserir mais energia ao sistema para rompê-las e fazer a substância mudar de estado de agregação.
Aproveite para conferir a nossa videoaula sobre o assunto: