O iodo, cujo símbolo é I, é um elemento químico pertencente à família dos halogênios (família 17 ou VII A) do quinto período. Seu número atômico é 53, o que significa que ele possui 53 prótons em seu núcleo e, no estado fundamental, apresenta também 53 elétrons. Na natureza existe somente um isótopo do iodo, que é o 127I, e sua massa molar é de 126,90 g/mol. O nome “iodo” vem do grego iodes, que significa “violeta”, em razão dos vapores desse elemento.
Conforme pode ser visto na imagem a seguir, em temperatura ambiente, o iodo é sólido e apresenta cristais negros de cor semelhante ao violeta com brilho metálico. Ele é perceptivelmente volátil (observe nas paredes do frasco que o contém) e sublima, isto é, passa diretamente do estado sólido para o estado gasoso. Para obtê-lo no estado líquido, é preciso aquecê-lo bem lentamente. Seu ponto de fusão é 113,8 ºC e seu ponto de ebulição é 183 ºC.
.jpg)
O iodo é um sólido que sublima em temperatura ambiente
Os vapores do iodo são bastante irritantes, podem estragar equipamentos de laboratório, como as balanças analíticas, e são rapidamente absorvidos pela pele. Por isso, ao trabalhar com o iodo, são necessários alguns cuidados, como o uso de equipamentos de proteção individual (óculos, luvas e máscaras).
O iodo é pouco solúvel em água, mas forma uma solução aquosa de coloração marrom. Ele dissolve-se melhor em solventes orgânicos, que se forem polares assim como a água, formarão soluções também marrons; mas se forem solventes apolares, a solução formada será violeta. A dissolução do iodo na água é mais facilitada quando ele é colocado na forma do seu composto iodeto de potássio. A tintura de iodo é uma solução de 2% de iodo (I2), 2,6% de triiodeto de potássio (KI3 → KI + I2) e álcool (por exemplo, tem-se uma mistura de 2,0 g de iodo e 2,6 g de KI3 em 100 mL de etanol), sendo usada na desinfecção da pele e limpeza de machucados.

Ampolas com solução de iodo
O iodo é diatômico, ou seja, sua molécula é formada por uma ligação covalente em que dois átomos de iodo compartilham um par de elétrons. No estado fundamental, seu átomo possui sete elétrons na camada de valência, mas ao realizarem a ligação covalente, ambos ficam com oito elétrons e com a configuração eletrônica do gás nobre Xe (xenônio: 2 – 8 – 18 – 18 – 8), tornando-se estáveis.
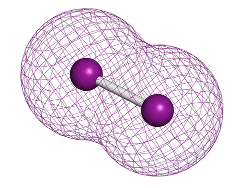
Molécula diatômica de iodo
As principais fontes de iodo são as algas marinhas que contêm o íon iodeto, I-. A primeira obtenção foi exatamente por meio das cinzas de algas pelo químico francês Bernard Courtois (1777-1838) em 1811. Gay-Lussac prosseguiu com os estudos desse elemento e mostrou que ele tinha propriedades semelhantes ao cloro (elemento da mesma família dos halogênios) e batizou-o de iodo em 1813.

As cinzas das algas marinhas são fontes de iodo
Outras fontes de iodo são as águas-mães do processamento do Salitre do Chile, que possuem o íon iodato (IO3-) do iodato de sódio (NaIO3), a água do mar que contém iodeto de sódio (NaI) e compostos petrolíferos em forma de iodeto de potássio (KI).
O iodo é importante porque possui amplas aplicações. Entre elas, está a sua adição ao cloreto de sódio (NaCl), ou seja, ao sal de cozinha. Desde o ano de 1953 é obrigatória por lei a adição de iodetos ou iodatos de sódio (NaI, NaIO3) e de potássio (KI, KIO3) ao sal. Isso porque o iodo é usado pela tireoide e sua deficiência no organismo pode causar distúrbios, principalmente o bócio. Para saber mais sobre esse assunto, leia o texto “Por que o iodo é adicionado ao sal?”.
Outra aplicação do iodo é em um teste chamado de índice de iodo, que é exatamente uma reação de halogenação (um tipo de reação de adição orgânica) para verificar se houve adulterações em óleos vegetais e gorduras. Também se utiliza iodo (I2) como gás inerte em lâmpadas de filamento de tungstênio para aumentar a sua vida útil.
Os isótopos radioativos 123I e 131I são usados na medicina nuclear para estudar a tireoide. Além disso, o 131I também é usado no tratamento de câncer de tireoide, pois, por acumular-se nesse órgão, suas radiações gama destroem as células cancerígenas.