A hibridização do fósforo, fenômeno físico que ocorre com os orbitais dos átomos desse elemento químico, possibilita a realização de um número de ligações acima do proposto pela teoria do octeto. Por essa razão, o fósforo é um elemento químico considerado uma exceção à regra do octeto.
Quando realizamos a distribuição eletrônica desse elemento, de número atômico = 15, no diagrama de Linus Pauling:

Distribuição eletrônica do fósforo
Percebemos que em sua camada de valência existem elétrons no subnível s (2 elétrons) e no subnível p (3 elétrons). Como no subnível s existe apenas um orbital, e no subnível p existem três orbitais, os elétrons estariam assim distribuídos:
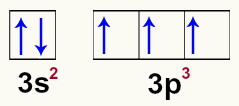
Distribuição dos elétrons nos orbitais da camada de valência do fósforo
Vale lembrar que, de acordo com Pauli, um orbital comporta, no máximo, dois elétrons com spins contrários (movimento de rotação). Acrescente-se ainda que o cientista Hund descobriu que um orbital somente recebe o seu segundo elétron quando todos os outros orbitais anteriores tiverem recebido o primeiro elétron.
Analisando os orbitais na camada de valência do fósforo, verificamos três orbitais incompletos, o que indica que o átomo desse elemento é capaz de realizar três ligações químicas, como na molécula do tricloreto de fósforo.
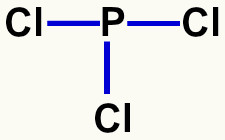
Fórmula estrutural do tricloreto de fósforo
Contudo, existem situações em que o fósforo pode realizar mais de três ligações, ou seja, apresentaria mais de três orbitais atômicos incompletos, como é o caso do fósforo no pentacloreto de fósforo.
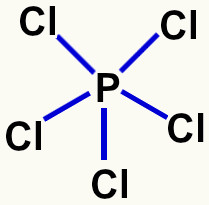
Fórmula estrutural do pentacloreto de fósforo
Como nesse composto o fósforo realiza as cinco ligações, ele deve apresentar os cinco orbitais incompletos, o que somente é possível por meio da hibridização.
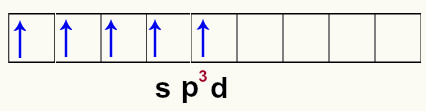
A hibridização do fósforo inicia quando o átomo recebe energia do meio externo, o que causa a excitação dos elétrons da camada de valência. Esse excesso de excitação dos elétrons faz com que um dos elétrons do orbital s passe a ocupar um dos orbitais vazios do subnível d. Esse momento é denominado estado excitado.
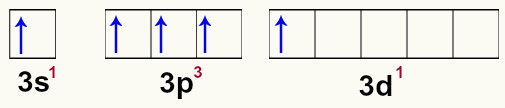
Representação dos orbitais do fósforo no estado excitado
Logo em seguida, os orbitais do fósforo sofrem uma fusão (união), que é a hibridização. Nessa hibridização, há a união de um orbital s com três orbitais p e um orbital d. Por causa disso, a hibridização do fósforo é denominada sp3d.