O texto Potencial-padrão de redução nas pilhas mostrou que cada metal que compõe uma pilha nos eletrodos possui um potencial-padrão de redução (E0red)e um de oxidação (E0oxi). Também foi dada uma tabela que fornece os valores dos potenciais-padrão de vários metais e ametais. Esta tabela segue abaixo:
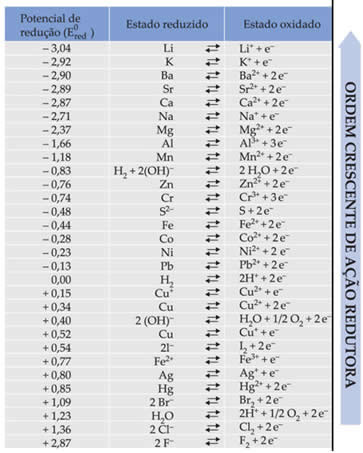
Esses valores serão necessários para que possamos calcular a voltagem (diferença de potencial (ddp) ou força eletromotriz (?E)) de uma pilha.
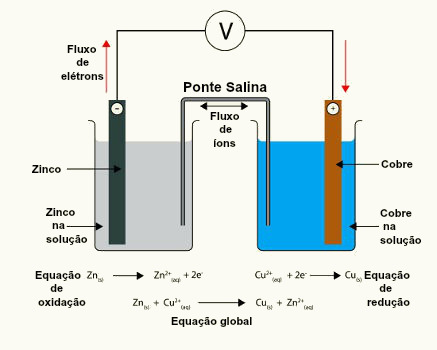
Digamos que temos uma pilha em que um dos eletrodos é formado pelo alumínio e o outro pelo cobre. Cada um desses metais está mergulhado em soluções aquosas de seus respectivos íons. Qual deles é o cátodo e qual é o ânodo? Qual é a ddp da pilha?
Para descobrirmos isso, basta olharmos as duas semirreações de redução e os potenciais-padrão de reduções desses metais na tabela, que são:
Al ↔Al3+ + 3e- E0red = -1,66 V
Cu ↔Cu2+ + 2e- E0red = +0,34 V
Veja que o potencial-padrão de redução do cobre é maior, portanto, ele será o metal que irá reduzir, ou seja, que vai ganhar elétrons, sendo o cátodo. E o alumínio será o ânodo, oxidando-se e recebendo os elétrons do cobre. As semirreações em cada eletrodo são dadas por:
Semirreação do ânodo: Al → Al3+ + 3e-
Semirreação do cátodo: Cu2+(aq) + 2e- →Cu(s)
Para descobrir a reação global, temos que multiplicar a semirreação do ânodo por 2 e a semirreação do cátodo por 3 para igualar os elétrons doados e recebidos:
Semirreação do ânodo: 2Al → 2Al3+ + 6e-
Semirreação do cátodo: 3Cu2+(aq) + 6e- → 3Cu(s)
Reação global da pilha:2Al + 3Cu2+(aq) → 2Al3+ + 3Cu(s)
Mas, e a força eletromotriz (?E0) ou diferença de potencial da pilha?
Existem duas fórmulas que podem ser usadas:
![]()
Assim, basta substituir os valores na fórmula:
?E0 = E0red (maior) - E0red (menor)
?E0 = +0,34 – (-1,66)
?E0 = + 2,0 V
Lembre-se de que os valores dos potenciais-padrão de oxidação são iguais aos valores dos potenciais-padrão de redução, porém com os sinais invertidos. Desse modo, temos:
?E0 = E0oxi (maior) - E0oxi (menor)
?E0 = +1,66 – (-0,34)
?E0 = + 2,0 V
Aproveite para conferir nossas videoaulas relacionada sobre o assunto: